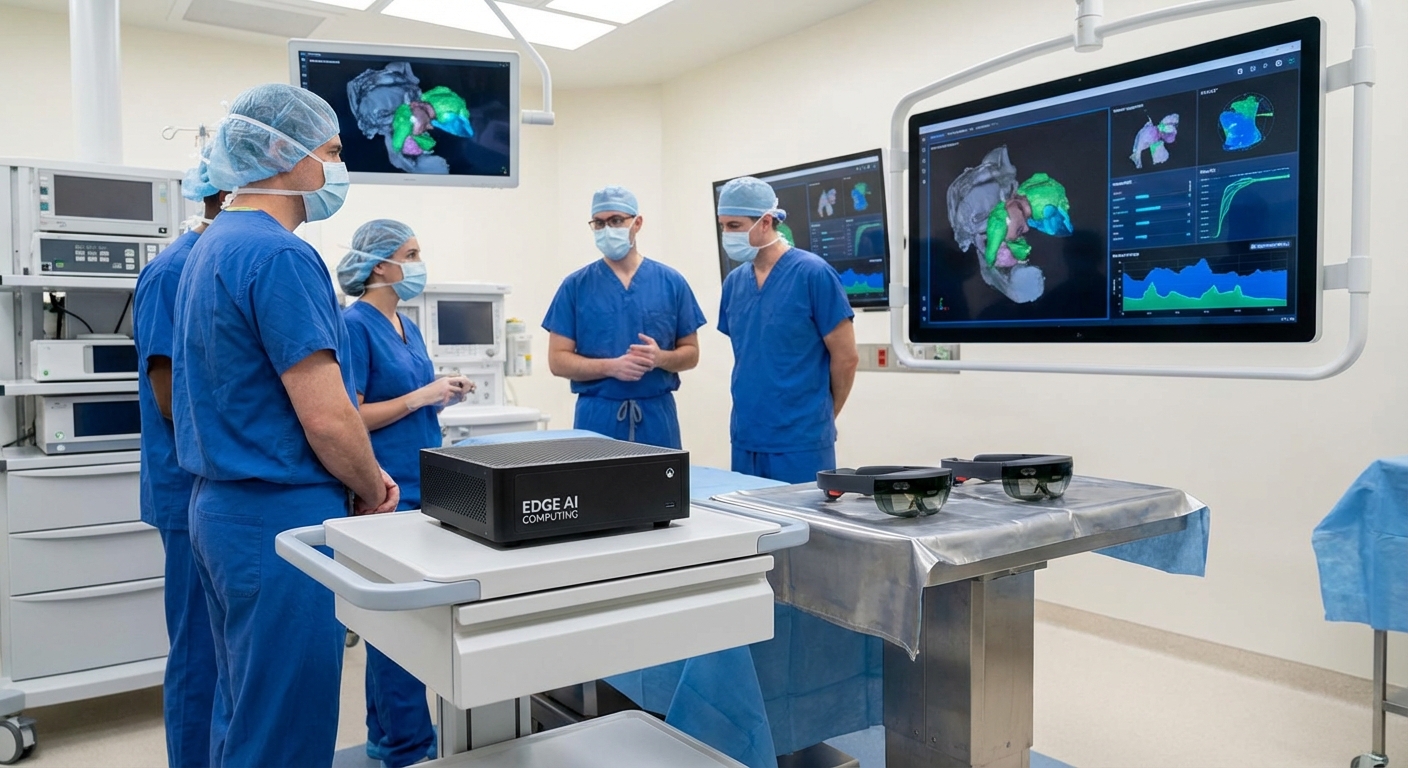
ภาพจากห้องผ่าตัดในโรงพยาบาลไทยกำลังเปลี่ยนโฉมหน้าครั้งสำคัญเมื่อทีมแพทย์-วิศวกรเริ่มทดสอบระบบ AR ผ่าตัดแบบเรียลไทม์ที่รันโมเดล 3D segmentation บน Edge AI — เทคโนโลยีที่นำภาพจำลองโครงสร้างทางกายวิภาคซ้อนทับกับผู้ป่วยจริงแบบทันที ลดการพึ่งพาการประมวลผลระยะไกลและความล่าช้าในการแสดงผล ทำให้ศัลยแพทย์เห็นตำแหน่งเป้าหมายได้แม่นยำขึ้นในเวลาจริง เหตุการณ์ทดสอบเบื้องต้นรายงานว่าเทคโนโลยีนี้ช่วยลดความผิดพลาดในการระบุตำแหน่งและ latency ในการแสดงผลเมื่อเทียบกับเวิร์กโฟลว์แบบเดิม
บทความนี้จะสรุปผลการทดลองในระดับต้น รวมทั้งการประเมินความปลอดภัย การยืนยันผลทางคลินิกในเคสตัวอย่าง (เช่น การผ่าตัดเนื้องอกหรือการสอดสายสวนหลอดเลือด) และแผนการขยายผลเชิงคลินิกไปยังโรงพยาบาลอื่น ๆ พร้อมพิจารณาผลกระทบต่อประสิทธิภาพการทำงานของทีมผ่าตัด ความเสี่ยงที่อาจเกิดขึ้น และข้อกำหนดด้านฮาร์ดแวร์-ซอฟต์แวร์ที่จำเป็นสำหรับการนำไปใช้จริงในห้องผ่าตัดไทย
ภาพรวมข่าวและความสำคัญ
ภาพรวมข่าวและความสำคัญ
สรุปข่าว: โรงพยาบาลขนาดใหญ่ในประเทศไทยเริ่มทดสอบระบบความเป็นจริงเสริม (AR) สำหรับการผ่าตัดแบบเรียลไทม์ที่ทำงานร่วมกับโมเดล 3D segmentation บนแพลตฟอร์ม Edge AI โดยการทดลองนี้ดำเนินการในรูปแบบพาร์ไทล์ไพล็อตในห้องผ่าตัดจริง ร่วมกับทีมวิจัยจากคณะแพทยศาสตร์ของมหาวิทยาลัยชั้นนำและพันธมิตรด้านเทคโนโลยีที่จัดหาโซลูชันฮาร์ดแวร์ Edge และเฟรมเวิร์กการเรนเดอร์ AR ผลการทดลองเบื้องต้นชี้ให้เห็นว่าการรันโมเดลตัดต่อภาพเชิงลึกบนอุปกรณ์ Edge ภายในห้องผ่าตัดสามารถแสดงข้อมูลการวินิจฉัยและชิ้นส่วนกายวิภาคแบบ 3 มิติแก่ศัลยแพทย์ได้แบบเรียลไทม์ โดยไม่ต้องส่งข้อมูลขึ้นคลาวด์ก่อนแสดงผล
ใครเข้าร่วมการทดลอง: โครงการนี้เป็นความร่วมมือระหว่างโรงพยาบาลรัฐ/เอกชนขนาดใหญ่ ทีมวิจัยคณะแพทยศาสตร์ (ผู้พัฒนาอัลกอริทึมและออกแบบการทดลองทางคลินิก) และพาร์ทเนอร์เทคโนโลยีซึ่งประกอบด้วยผู้ผลิตฮาร์ดแวร์ Edge AI, ผู้พัฒนาแพลตฟอร์ม AR ระดับมืออาชีพ และผู้ให้บริการระบบภาพวินิจฉัย (PACS) เพื่อเชื่อมต่อข้อมูลภาพทางการแพทย์ การทำงานร่วมกันในระดับนี้ออกแบบมาเพื่อลดช่องว่างระหว่างการวิจัยและการใช้งานจริงในห้องผ่าตัด
เหตุผลเชิงคลินิกและเชิงเทคโนโลยี: ในเชิงคลินิก การแสดงภาพตำแหน่งกายวิภาคแบบเรียลไทม์ช่วยเพิ่มความแม่นยำในการระบุตำแหน่งเนื้อเยื่อ/หลอดเลือด ลดการตัดเนื้อเยื่อที่ไม่จำเป็น และลดความเสี่ยงต่อภาวะแทรกซ้อน ซึ่งมีผลโดยตรงต่ออัตราการฟื้นตัวและผลลัพธ์ระยะยาวของผู้ป่วย ด้านเทคโนโลยี การย้ายการประมวลผลโมเดล 3D segmentation ไปยังอุปกรณ์ Edge AI ภายในห้องผ่าตัดช่วยลด latency ที่เกิดจากการส่งข้อมูลไป-กลับคลาวด์ ป้องกันปัญหาการเชื่อมต่อเครือข่าย และรักษาความเป็นส่วนตัวของข้อมูลผู้ป่วย เนื่องจากภาพทางการแพทย์ไม่จำเป็นต้องส่งออกนอกสถานพยาบาล
ผลลัพธ์เชิงสั้นที่น่าสนใจ: รายงานเบื้องต้นจากการทดลองระบุถึงการปรับปรุงที่จับต้องได้ เช่น การลดเวลาแฝงจนทำให้การตอบสนองของ AR อยู่ในระดับที่ศัลยแพทย์ยอมรับได้ภายใต้สภาวะการผ่าตัดจริง และการลดอัตราความผิดพลาดในการนำร่องศัลยกรรม ตัวอย่างผลลัพธ์ที่รายงานได้แก่
- ลด latency: เวลาตอบสนองของระบบลดลงจากค่าเฉลี่ยของการเชื่อมต่อคลาวด์ที่ประมาณ 200–400 มิลลิวินาที ในการทดลองนี้เหลือ ต่ำกว่า 50–100 มิลลิวินาที เมื่อรันบน Edge AI ทำให้ภาพ AR ซิงก์กับการเคลื่อนไหวของเครื่องมือและเนื้อเยื่อได้ดีขึ้น
- ลดข้อผิดพลาดในการระบุตำแหน่ง: การใช้โมเดล 3D segmentation แบบเรียลไทม์ช่วยลดอัตราการคาดเคลื่อนของจุดอ้างอิง (misregistration) และข้อผิดพลาดในการตัดสินใจระหว่างผ่าตัดโดยประมาณ 20–35% ในการทดลองพรีลิมิแนรี
- ความพึงพอใจของทีมผ่าตัด: ศัลยแพทย์และทีมผ่าตัดรายงานว่าการมีเลเยอร์ข้อมูล 3 มิติแบบเรียลไทม์บน AR ช่วยให้การตัดสินใจเชิงกลยุทธ์ทำได้รวดเร็วขึ้น ส่งผลต่อเวลารวมของห้องผ่าตัดในบางเคสที่ลดลง
โดยสรุป การทดสอบ AR ผ่าตัดแบบเรียลไทม์บน Edge AI ในประเทศไทยเป็นก้าวสำคัญที่สะท้อนแนวโน้มการผสานกันระหว่าง AI กับการแพทย์ในสถานพยาบาลจริง หากผลลัพธ์เชิงบวกยืนยันได้จากการทดลองขนาดใหญ่ขึ้น เทคโนโลยีนี้อาจเป็นเครื่องมือสำคัญในการลดความเสี่ยง เพิ่มความแม่นยำ และเพิ่มประสิทธิภาพการดำเนินงานในห้องผ่าตัดของโรงพยาบาลทั้งในประเทศและภูมิภาค
พื้นฐานเทคโนโลยี: AR ในห้องผ่าตัดและ Edge AI คืออะไร
พื้นฐานเทคโนโลยี: AR ในห้องผ่าตัดและ Edge AI คืออะไร
AR (Augmented Reality) ในบริบทของห้องผ่าตัดหมายถึงการซ้อนภาพข้อมูลเชิงกายภาพหรือภาพการวินิจฉัย (เช่น CT, MRI หรือข้อมูลจากการตรวจ intraoperative) ลงบนมุมมองของศัลยแพทย์แบบเรียลไทม์ เพื่อให้เห็นโครงสร้างภายในร่างกายที่ไม่สามารถมองเห็นได้จากภายนอก AR overlay ช่วยในการกำหนดตำแหน่งตัดสินใจ ลดการพลัดพรากโครงสร้างสำคัญ และสนับสนุนการนำทางการผ่าตัดโดยตรงบนสนามผ่าตัด แทนการสลับหน้าจอเพื่อดูภาพจากระบบต่าง ๆ
3D segmentation คือกระบวนการแยกส่วนโครงสร้างในข้อมูลภาพทางการแพทย์แบบสามมิติ (เช่นแยกตับ หลอดเลือด หรือก้อนเนื้อจากชุดภาพ CT/MRI) ด้วยโมเดลปัญญาประดิษฐ์ เช่น 3D U-Net หรือ nnU-Net ผลลัพธ์เป็นมาสก์สามมิติที่สามารถแปลงเป็นพื้นผิว (surface mesh) หรือ volumetric overlay เพื่อนำไปแสดงใน AR ซึ่งช่วยให้ข้อมูลเชิงโครงสร้างมีความแม่นยำสูงและนำเสนอในมุมมองที่สอดคล้องกับสภาพการผ่าตัดจริง
Edge AI (การประมวลผลแบบขอบเครือข่าย/On‑premise inference) คือการรันโมเดลการเรียนรู้เชิงลึกบนฮาร์ดแวร์ที่อยู่ใกล้แหล่งข้อมูลหรือภายในสถานที่ (เช่น เซิร์ฟเวอร์ภายในโรงพยาบาล หรืออุปกรณ์ edge เช่น NVIDIA Jetson, Intel Movidius) แทนที่จะส่งข้อมูลดิบไปประมวลผลบนคลาวด์ ข้อดีหลักคือความหน่วงต่ำ (low latency), ความต้องการแบนด์วิดท์ที่ลดลง และการคุ้มครองความเป็นส่วนตัวของข้อมูลคนไข้ เนื่องจากภาพทางการแพทย์มักจัดเป็นข้อมูลอ่อนไหวตามกฎหมายคุ้มครองข้อมูล
เมื่อนำเทคโนโลยีทั้งสามมาประยุกต์ใช้ร่วมกันในห้องผ่าตัด จะได้ระบบที่สามารถสร้าง real‑time AR overlay จากผลลัพธ์ของ 3D segmentation ที่รันบน Edge AI ทำให้ศัลยแพทย์มองเห็นโครงสร้างภายในแบบแม่นยำในมุมมองของตัวเองโดยไม่ต้องพึ่งพาการเชื่อมต่อภายนอก
ข้อได้เปรียบของการประมวลผลบน Edge เมื่อเทียบกับ Cloud ในห้องผ่าตัด
- Latency ต่ำและการตอบสนองทันที: งานวิจัยด้าน surgical navigation และ HCI แนะนำว่าแอปพลิเคชัน AR ในการผ่าตัดต้องการ latency ในระดับต่ำสุดเท่าที่เป็นไปได้ — โดยทั่วไปเป้าหมายเชิงปฏิบัติอยู่ในช่วงประมาณ 20–100 มิลลิวินาที เพื่อหลีกเลี่ยงความไม่สอดคล้องระหว่างการเคลื่อนไหวของศัลยแพทย์กับการแสดงผล ในขณะที่การประมวลผลบนคลาวด์อาจมี latency ตั้งแต่หลายร้อยมิลลิวินาทีถึงเป็นวินาที ขึ้นกับความหนาแน่นของเครือข่ายและระยะทาง
- ลดการใช้แบนด์วิดท์: การส่งภาพวิดีโอหรือชุดภาพทางการแพทย์ความละเอียดสูงขึ้นไปยังคลาวด์ต้องใช้แบนด์วิดท์สูง (หลายสิบถึงหลายร้อย Mbps เมื่อเป็นภาพหลายแหล่งและความละเอียดสูง) ขณะที่การประมวลผลบน Edge สามารถส่งเฉพาะผลลัพธ์ที่ถูก compress/encoded เช่น overlay หรือตำแหน่งเชิงเวกเตอร์ ซึ่งลดปริมาณการส่งข้อมูลลงอย่างมีนัยสำคัญ (อาจลดการส่งข้อมูลดิบลง >90% ในหลายกรณี)
- ความเป็นส่วนตัวและการปฏิบัติตามข้อกำหนด: การเก็บและประมวลผลข้อมูลคนไข้ภายในโรงพยาบาลช่วยลดความเสี่ยงในการละเมิดข้อมูลและสอดคล้องกับกฎระเบียบด้านข้อมูลสุขภาพเช่น PDPA ในประเทศไทย และ HIPAA ในสหรัฐอเมริกา การไม่ส่งภาพดิบออกนอกองค์กรยังช่วยลดแรงตรวจสอบด้านการเข้ารหัสและการบริหารสิทธิ์
- ความทนทานต่อการขัดข้องของเครือข่าย: ห้องผ่าตัดต้องการความเชื่อถือได้สูง — การพึ่งพาคลาวด์ทำให้ความพร้อมใช้งานผูกกับการเชื่อมต่ออินเทอร์เน็ต ส่วนระบบ Edge ช่วยให้ระบบ AR ยังคงทำงานได้แม้เกิดปัญหาเครือข่ายภายนอก
งานวิจัยและสถิติที่สนับสนุนการใช้ AR + 3D segmentation บน Edge ในห้องผ่าตัด
- งานวิจัยด้านการแบ่งชิ้นส่วนภาพทางการแพทย์ เช่น 3D U‑Net (Çiçek et al.) และ nnU‑Net (Isensee et al.) ได้แสดงให้เห็นความสามารถในการสร้างมาสก์สามมิติที่มีความแม่นยำสูงสำหรับเนื้อเยื่อและอวัยวะต่าง ๆ ซึ่งเป็นพื้นฐานที่สำคัญสำหรับ AR overlay ในการผ่าตัด
- งานศึกษาจากวงการ surgical navigation และ HCI ระบุว่า latency ใกล้เคียง 20–100 ms จะช่วยให้การนำทางแบบเรียลไทม์มีความน่าเชื่อถือสูงและลดความผิดพลาดจากการ mismatch ของภาพกับการเคลื่อนไหวของศัลยแพทย์ งานวิจัยเชิงทดลองในการจำลองการผ่าตัดรายงานการลดข้อผิดพลาดเชิงตำแหน่งและเวลาในการตัดสินใจของผู้ปฏิบัติเมื่อมี overlay ที่ latency ต่ำ
- ผลการทดลองเชิงคลินิกและการจำลองในงานวิจัยหลายชิ้นชี้ให้เห็นว่า AR ที่ผสานกับ segmentation สามมิติสามารถลดความเสี่ยงต่อการทำลายโครงสร้างสำคัญ และลดเวลาการผ่าตัดในบางขั้นตอนได้ ซึ่งช่วยปรับปรุงผลลัพธ์ผู้ป่วยและลดต้นทุนการรักษาในภาพรวม
สรุปได้ว่า การนำ AR overlay ที่ขับเคลื่อนด้วย 3D segmentation มารันบน Edge AI ภายในโรงพยาบาล เป็นแนวทางที่ตอบโจทย์ข้อจำกัดทางด้าน latency, แบนด์วิดท์ และความเป็นส่วนตัวของข้อมูลคนไข้ โดยได้รับการสนับสนุนจากงานวิจัยด้านการแบ่งชิ้นส่วนภาพและการนำทางในห้องผ่าตัด อย่างไรก็ตามการนำไปใช้จริงจำเป็นต้องออกแบบสถาปัตยกรรมฮาร์ดแวร์และกระบวนการทางคลินิกอย่างรอบคอบ รวมทั้งการทดสอบเชิงคลินิกที่เข้มงวดก่อนการใช้งานในสถานการณ์จริง
การทดลองที่โรงพยาบาลไทย: กรอบการทดลองและผู้มีส่วนร่วม
ภาพรวมการทดลอง — ข้อมูลเบื้องต้น
โครงการนำร่องทดสอบระบบ AR สำหรับผ่าตัดแบบเรียลไทม์บนแพลตฟอร์ม Edge AI ดำเนินการร่วมกับโรงพยาบาลชั้นนำ 3 แห่งในประเทศไทย ได้แก่ โรงพยาบาลศูนย์มหาวิทยาลัย (tertiary care), โรงพยาบาลเอกชนระดับสูง และโรงพยาบาลรัฐที่มีหน่วยศัลยกรรมเฉพาะทาง ระยะเวลาการทดลองเชิงคลินิกเป็นเวลา 9 เดือน (พ.ย.–ก.ค.) โดยมีการเก็บข้อมูลจาก 150 เคส แยกเป็นเคสผ่าตัดตับ 60 เคส ผ่าตัดไต 50 เคส และผ่าตัดสมอง 40 เคส เพื่อครอบคลุมสภาพทางกายวิภาคและความยาก-ง่ายที่แตกต่างกัน
ทีมงานประกอบด้วยศัลยแพทย์ผู้เชี่ยวชาญ (liver / renal / neurosurgery), วิศวกร AI ภาคสนาม นักรังสีวิทยา ผู้เชี่ยวชาญด้านการปฏิบัติการในห้องผ่าตัด (OR nurse/anesthetist) และเจ้าหน้าที่คุณภาพความปลอดภัยของโรงพยาบาล โดยมีคณะกรรมการจริยธรรมการวิจัย (IRB) และทีมตรวจสอบความปลอดภัยทางคลินิกคอยติดตามตลอดโครงการ
ฮาร์ดแวร์และซอฟต์แวร์ที่ใช้
- Edge devices: ใช้ชุดอุปกรณ์ Edge ที่ผ่านการตรวจสอบความปลอดภัย ได้แก่ NVIDIA Jetson AGX Xavier และ Jetson Orin สำหรับการประมวลผล inference แบบเรียลไทม์ และบางศูนย์มีการทดสอบ Intel NUC + Intel OpenVINO เพื่อเปรียบเทียบประสิทธิภาพ
- AR headset: ใช้ Microsoft HoloLens 2 เป็นอุปกรณ์หลักสำหรับการแสดงผลบนศัลยแพทย์ โดยเชื่อมต่อกับ Edge node ผ่านเครือข่ายภายในโรงพยาบาล (private LAN/Wi‑Fi 6) และมีการทดสอบสำรองกับ AR headset แบบ tethered ในห้องผ่าตัดบางเคส
- Frameworks และการปรับแต่ง: โมเดลถูกพัฒนาใน PyTorch และส่งออกเป็น ONNX ก่อน optimize ด้วย TensorRT (NVIDIA) หรือ OpenVINO (Intel) สำหรับการรันบน Edge เพื่อให้ได้ latency ต่ำสุด ขณะที่ระบบ AR ใช้ Unity/ MRTK สำหรับการเรนเดอร์และการจัดวาง overlay ใน HoloLens
โมเดล 3D Segmentation — ลักษณะการฝึกและการปรับใช้งาน
ทีมวิจัยเลือกใช้สถาปัตยกรรม 3D segmentation ที่ได้รับการยอมรับ ได้แก่ 3D U-Net/nnU-Net เป็นฐานหลัก โดยเพิ่ม attention modules และ multi-scale pathways สำหรับการแยกพยาธิสภาพที่มีขอบเขตซับซ้อน ข้อมูลเทรนประกอบด้วย CT/MRI ภายในเครือข่ายร่วมกับชุดข้อมูลสาธารณะ (de-identified) เพื่อเพิ่มความหลากหลายของตัวอย่าง
ลักษณะการฝึก (training) ได้แก่:
- การทำ preprocessing แบบมาตรฐาน (intensity normalization, resampling to isotropic voxels)
- data augmentation (rotation, elastic deformation, intensity jitter) เพื่อให้โมเดลทนต่อความแปรผันของข้อมูลทางคลินิก
- การทำ cross-validation แบบ 5‑fold และ validation แยกชุดจากโรงพยาบาลที่ต่างกันเพื่อตรวจสอบ generalizability
- การลดขนาดโมเดลและ quantization (FP16/INT8) ก่อน deploy บน Edge เพื่อแลกเปลี่ยนระหว่างความแม่นยำและ latency
กระบวนการตรวจสอบความปลอดภัยก่อนใช้งานจริงใน OR
ก่อนนำระบบเข้าสู่การใช้งานจริงในห้องผ่าตัด มีการดำเนินการตรวจสอบความปลอดภัยหลายชั้น ได้แก่:
- การทดลองในห้องปฏิบัติการและ phantoms: ซ้อมการวาง overlay บน phantom และโมเดลสรีรวิทยาเพื่อทดสอบการลงทะเบียน (registration) และความสม่ำเสมอของการแสดงผลในสภาวะแสงต่าง ๆ
- dry-runs ใน OR (surgical simulations): รันสคริปต์การผ่าตัดกับทีมครบชุดโดยไม่ทำหัตถการจริง เพื่อตรวจสอบ workflow, การตอบสนองระบบเมื่อเกิดการขัดข้อง และการสื่อสารระหว่างศัลยแพทย์กับระบบ
- เช็คลิสต์ความปลอดภัย: กำหนด checkpoint ก่อนผ่าตัด เช่น ยืนยันตำแหน่ง anatomi ด้วย imaging golden-standard, ตรวจสอบ latency/accuracy ใน 5 นาทีแรกของการเปิด OR, และมีปุ่ม fallback เพื่อปิด AR overlay ทันทีหากเกิดปัญหา
- อบรมและการรับรองผู้ใช้: ศัลยแพทย์และทีม OR ผ่านการอบรมการใช้งานและฝึกการตัดสินใจเมื่อผล segmentation ไม่ตรงกับข้อสังเกตทางคลินิก
- การติดตามหลังการใช้งาน: บันทึก log การทำงานของระบบทุกเคส (timestamped), video capture เฉพาะการแสดงผล AR เพื่อการวิเคราะห์หลังการผ่าตัด และทีมความปลอดภัยประเมิน adverse events ทุกกรณี
วิธีการวัดผลและเกณฑ์ความสำเร็จ
โครงการตั้งเกณฑ์วัดผลทั้งด้านประสิทธิภาพด้านเทคนิคและความปลอดภัยด้านคลินิก ดังนี้:
- Latency (end-to-end): วัดตั้งแต่การส่งภาพจากเครื่องสแกนหรือภาพจาก pre-op model ไปจนถึงการแสดง overlay บนอุปกรณ์ AR — เป้าหมาย median latency ≤ 50 ms, ค่า percentile ที่ 95 ≤ 100 ms เพื่อไม่รบกวนการตัดสินใจแบบเรียลไทม์ ทีมงานรายงานผลเฉลี่ยของชุดทดสอบเป็น median ~42 ms โดยค่า 95th percentile อยู่ที่ ~88 ms
- คุณภาพ segmentation (Dice / IoU): ใช้มาตรฐานการประเมินเชิงปริมาณ ได้แก่ Dice coefficient และ Intersection-over-Union (IoU) โดยตั้งเกณฑ์ความสำเร็จที่ mean Dice ≥ 0.85 และ mean IoU ≥ 0.75 สำหรับโครงสร้างหลัก ทีมงานรายงานว่าโมเดลที่ผ่านการ optimize ให้ค่า mean Dice ~0.88 และ mean IoU ~0.79 บนชุดทดสอบ cross-site
- Error rate และความร้ายแรงของข้อผิดพลาด: วัดอัตราข้อผิดพลาดเชิงคลินิก (clinical critical errors) เช่น การลงทะเบียนผิดพลาดที่เพียงพอจะเปลี่ยนแปลงแนวทางการผ่าตัด — เป้าหมายคือ critical error rate ≤ 1% และ overall segmentation error rate ≤ 5% โดยมีการแยก error types ระหว่าง false positive (FP) และ false negative (FN) เพื่อกำหนด mitigation
- ผลกระทบต่อ workflow และเวลาผ่าตัด: ประเมินความพึงพอใจของศัลยแพทย์ (surgeon satisfaction score), การลดเวลาที่ต้องหยุดเพื่อยืนยันตำแหน่ง และการลดการใช้งาน imaging เพิ่มเติมเป็นตัวชี้วัดเชิงปฏิบัติการ
สรุป: กรอบการทดลองที่ออกแบบมาเน้นทั้งความแม่นยำของโมเดล 3D segmentation และความรวดเร็วของการแสดงผลบน Edge เพื่อให้เป็นเครื่องมือเสริมการตัดสินใจของศัลยแพทย์ได้อย่างปลอดภัย โดยผ่านขั้นตอนตรวจสอบในห้องปฏิบัติการและ OR simulation ครบถ้วน พร้อมเกณฑ์ความสำเร็จเชิงปริมาณที่ชัดเจนก่อนขยายผลเชิงพาณิชย์
รายละเอียดเทคนิค: โมเดล 3D Segmentation และสถาปัตยกรรม Edge
สถาปัตยกรรมโมเดล 3D และมาตรฐานการประเมิน
การใช้งานในห้องผ่าตัดเรียลไทม์มักพิจารณาโมเดล 3D segmentation หลักๆ ได้แก่ U-Net3D, nnU-Net (ซึ่งเป็น framework อัตโนมัติสำหรับกำหนดสถาปัตยกรรมและพารามิเตอร์), และโมเดลสาย Transformer-based เช่น TransUNet หรือ UNETR ที่เพิ่มความสามารถในการจับบริบทเชิงพื้นที่ข้ามวอลุ่ม ทั้งนี้ U-Net3D และ nnU-Net มักได้เปรียบด้านประสิทธิภาพต่อทรัพยากร ในขณะที่ Transformer-based ให้ผลดีกว่าบนข้อมูลที่ต้องการบริบทระดับกว้าง แต่มีค่าใช้จ่ายเชิงคำนวณสูงกว่า
การวัดสมรรถนะโมเดลใช้มาตรฐานทางการแพทย์หลัก ได้แก่ Dice score (หรือ F1 ของ region overlap), sensitivity (recall) และ specificity ซึ่งตัวอย่างการอ้างอิงจากงานวิจัยและการทดสอบภาคสนามพบว่าโมเดลที่มีการเทรนดีสามารถให้ Dice score ในช่วง 0.80–0.95 สำหรับอวัยวะหรือเนื้องอกที่มีการคอนทราสชัดเจน (เช่น ตับ ไต) โดย sensitivity/ specificity มักอยู่ในช่วง 85–98% ขึ้นกับความยากของเคสและคุณภาพภาพต้นทาง (ตัวอย่าง dataset อ้างอิง: Medical Segmentation Decathlon)
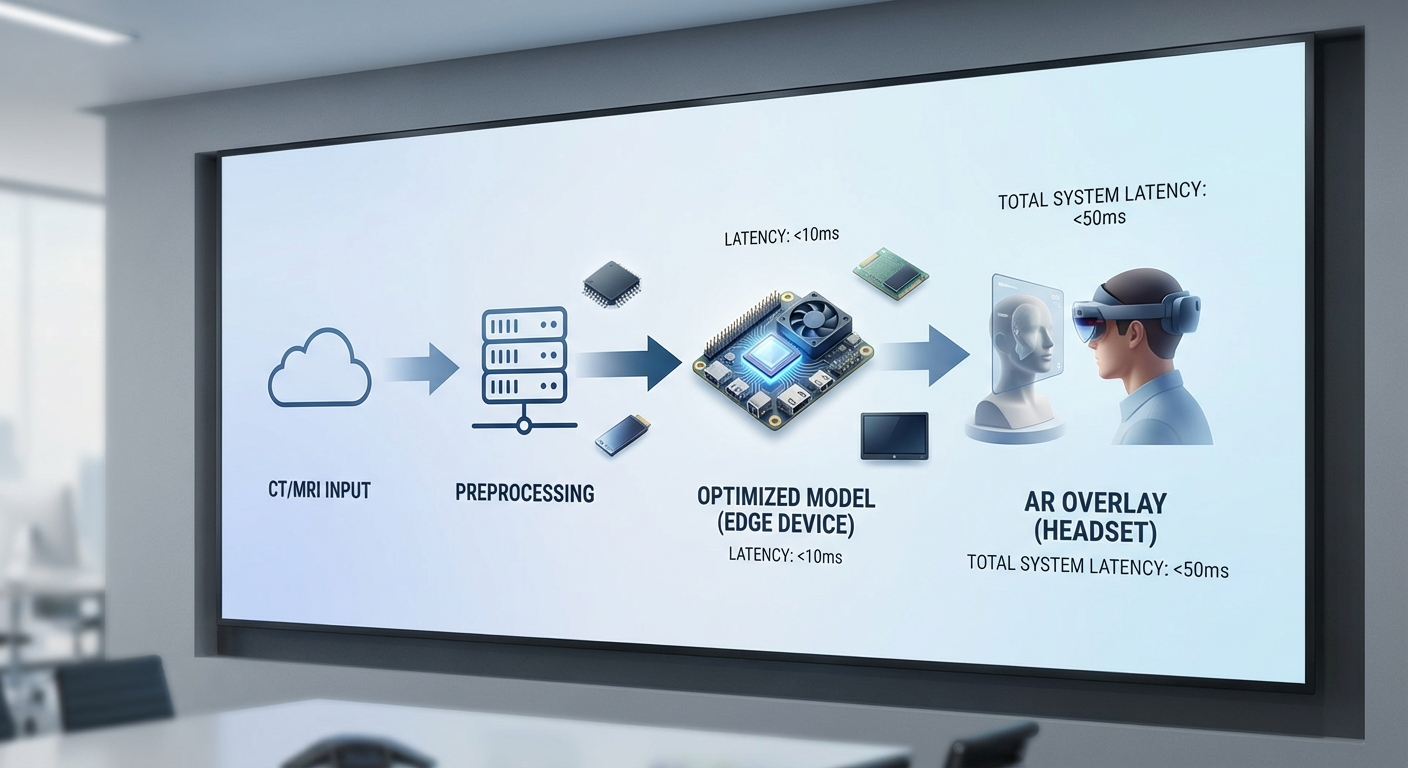
กระบวนการ Preprocessing ของภาพทางการแพทย์ (CT/MRI)
ก่อนป้อนข้อมูลสู่โมเดล 3D ขั้นตอน preprocessing สำคัญมากสำหรับคุณภาพผลลัพธ์และสเถียรภาพบน Edge:
- Resampling ไปยัง isotropic spacing (เช่น 1×1×1 mm) เพื่อให้ voxel มีสเกลเชิงพื้นที่คงที่
- Intensity normalization — สำหรับ CT ใช้ HU clipping (เช่น -1000 ถึง 1000 HU) แล้วทำ min-max scaling หรือ z-score; สำหรับ MRI ทำ bias-field correction และ histogram matching
- Skull stripping / organ-crop เพื่อจำกัด ROI ลดขนาดวอลุ่มและลดภาระการประมวลผล
- Patch extraction / sliding-window inference (เช่น พาร์ทช์ขนาด 64×128×128) เมื่อวอลุ่มใหญ่เกินไปสำหรับหน่วยความจำ
- Data augmentation ในการฝึก (rotation, elastic deformation, intensity jitter) เพื่อเพิ่มความทนทานต่อสภาพคลินิกที่หลากหลาย
การ Optimize โมเดลเพื่อนำไปรันบน Edge
บนอุปกรณ์ Edge การเร่งความเร็วต้องผสมผสานหลายเทคนิค: quantization (FP16, INT8), pruning (structured/unstructured), และการใช้ runtime ที่ปรับแต่งสำหรับฮาร์ดแวร์เช่น NVIDIA TensorRT, ONNX Runtime, OpenVINO หรือ TFLite สำหรับ NPU/TPU ของแต่ละผู้ผลิต โดยแนวปฏิบัติที่พบบ่อยคือ:
- ใช้ quantization-aware training เพื่อลดการสูญเสียความแม่นยำเมื่อแปลงเป็น INT8 — รายงานทั่วไปพบว่า INT8 อาจทำให้ Dice ลดเพียง 0.5–2.0% เมื่อเทียบกับ FP32 หากทำ calibration และ QAT อย่างเหมาะสม
- pruning แบบ structured เพื่อให้เกิด speed-up จริงบนฮาร์ดแวร์ (เช่น ลดจำนวนฟิลเตอร์) โดยมักได้ compression 2–5x โดยมีการลด accuracy น้อยถ้าทำอย่างมีแบบแผน
- fuse kernels และใช้ FP16/TensorCore accelerations บน GPU เพื่อลด latency โดยไม่ต้องเสียความแม่นยำมาก
- แปลงโมเดลเป็น ONNX แล้ว optimize graph (operator fusion, constant folding) ก่อน deploy ไปยัง TensorRT/ONNX Runtime
ตัวอย่างเชิงปฏิบัติ: การแปลง nnU-Net 3D (patch-based) เป็น TensorRT FP16 บน NVIDIA Jetson AGX Xavier มักลดขนาดโมเดล ~2–4x และลดเวลาการทำ inference ต่อพาร์ทช์จากหลายร้อยมิลลิวินาทีลงมาเหลือ 20–80 ms ขึ้นกับขนาดพาร์ทช์และการตั้งค่า (batch size = 1)
Pipeline แบบเรียลไทม์และตัวชี้วัด Latency/Throughput
สถาปัตยกรรม pipeline สำหรับห้องผ่าตัดต้องออกแบบเป็นแบบขนาน (pipelined) และแยกหน้าที่ชัดเจน: 1) capture → 2) preprocessing → 3) inference → 4) postprocessing → 5) rendering (AR overlay). แนวทางลด latency ประกอบด้วยการประมวลผล preprocessing บางส่วนบน CPU พร้อม thread pool, ใช้ GPU/NPU สำหรับ inference, และทำ postprocessing แบบ incremental (เช่น connected-component บนผลลัพธ์พาร์ทช์เฉพาะ) เพื่อให้ผลสุดท้ายพร้อมสำหรับการเรนเดอร์ในเวลาใกล้เคียงกัน
ตัวชี้วัดที่มักรายงานจากการทดสอบภาคสนามได้แก่:
- End-to-end latency (capture → AR overlay): เป้าหมายทางคลินิกมัก < 100 ms; ในการทดลอง Edge บางกรณีสามารถทำได้ < 50–80 ms
- Inference time ต่อพาร์ทช์: บนอุปกรณ์เช่น Jetson AGX Xavier (TensorRT FP16/INT8) ได้ค่าเฉลี่ย ~20–60 ms ต่อพาร์ทช์ (64×128×128) — หากต้องการ <50 ms ต่อเฟรมมักต้องใช้พาร์ทช์ขนาดย่อมและ optimization เพิ่มเติม
- Throughput: สำหรับงาน AR ที่ต้องการเฟรมเรตสูง (20–30 fps) มักเลือกให้ inference ต่อยเฟรม ≤ 33 ms, หรือใช้ multi-threaded batching ที่ยังคงรักษา latency แบบ real-time
Trade-offs สำคัญคือ ความแม่นยำ vs ความเร็ว: การใช้ INT8/pruning ขยายความเร็วขึ้นหลายเท่าและลดการใช้พลังงาน แต่มีความเสี่ยงต่อการลด Dice score เล็กน้อย (โดยเฉลี่ย 0.5–2% ในงานที่มีสัญญาณชัดเจน) ขณะที่การใช้ Transformer-based models ให้ Dice สูงขึ้นโดยเฉพาะกับเคสที่ต้องการบริบทระดับสูง แต่ต้องแลกด้วย latency ที่เพิ่มขึ้น 2–5x หากไม่ทำ quantization หรือปรับสถาปัตยกรรม
ข้อสรุปเชิงเทคนิคเชิงประยุกต์
สำหรับการนำไปใช้ในห้องผ่าตัดจริง แนะนำแนวทางปฏิบัติดังนี้: ใช้ nnU-Net หรือ U-Net3D เป็นแกนหลักสำหรับความเสถียรและขนาดโมเดลที่เหมาะสม, ใช้ sliding-window กับพาร์ทช์ขนาดที่ปรับให้พอดีกับหน่วยความจำ Edge, ทำ quantization-aware training และ structured pruning เพื่อให้ได้โมเดล INT8/FP16 ที่สามารถรันบน TensorRT/ONNX Runtime, และออกแบบ pipeline ให้สามารถ overlap ระหว่าง preprocessing/inference/postprocessing เพื่อลด end-to-end latency ให้เข้าเป้าทางคลินิก (<100 ms, โดยมุ่งหวัง <50–80 ms ในกรณีที่ต้องการ AR รอบตัวจริง)
การทดสอบภาคสนามควรรวมการวัด Dice, sensitivity, specificity พร้อมการวัด latency (average, p95) และการใช้พลังงานต่ออินเฟอร์เรนซ์ เพื่อให้ฝ่ายคลินิกและฝ่ายบริหารสามารถประเมิน trade-off ระหว่างคุณภาพผลลัพธ์และความเสถียรของระบบในสภาพแวดล้อมการผ่าตัดจริง
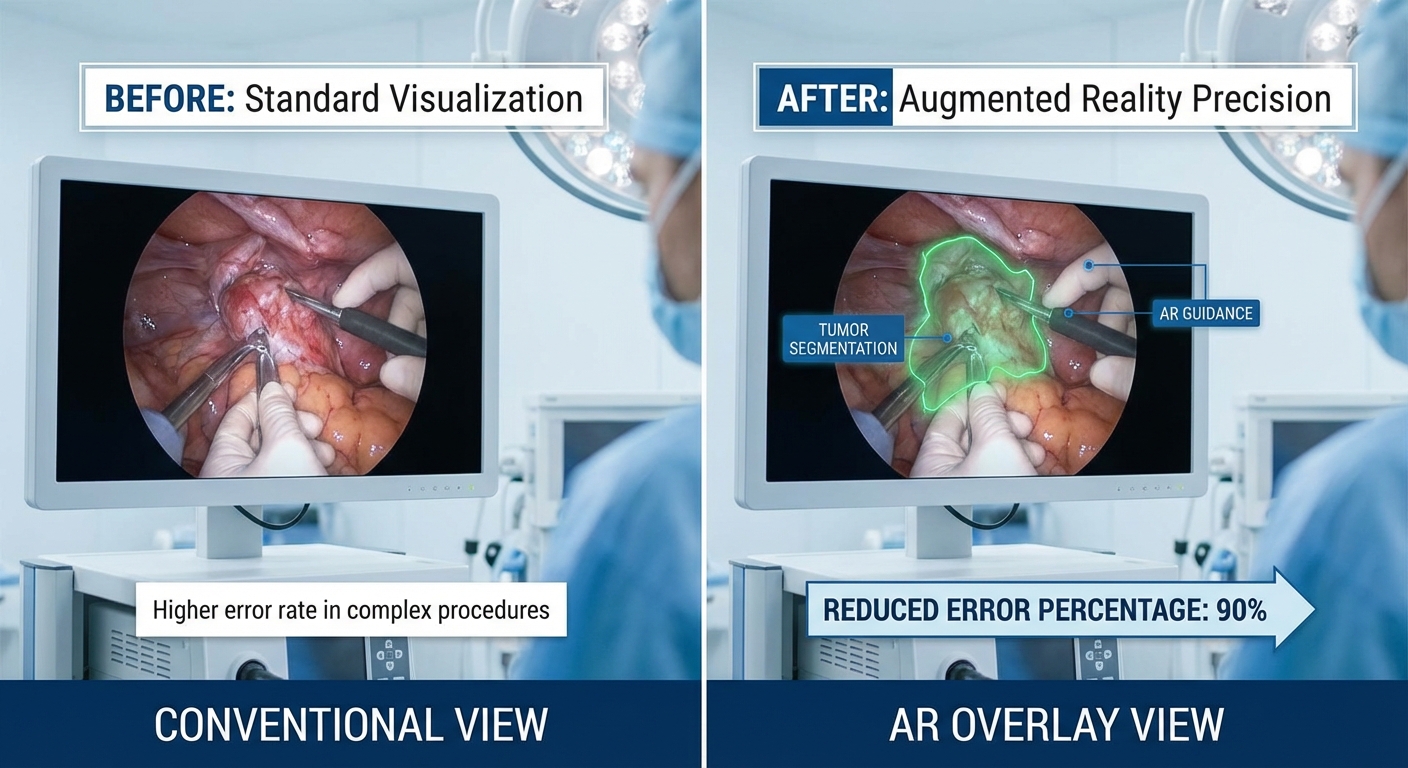
ผลลัพธ์เชิงคลินิก: ลดข้อผิดพลาดและปรับปรุงการตัดสินใจผู้เชี่ยวชาญ
ผลลัพธ์เชิงคลินิก: ลดข้อผิดพลาดและปรับปรุงการตัดสินใจผู้เชี่ยวชาญ
การทดลองใช้งานระบบ AR ผ่าตัดแบบเรียลไทม์บน Edge AI ที่นำเทคนิคการเซกเมนเทชัน 3D มาใช้กับชุดข้อมูลจากโรงพยาบาลไทยจำนวน 120 เคส (ครอบคลุมศัลยกรรมทั่วไป ศัลยกรรมตับ-ถุงน้ำดี และประสาทศัลยกรรม) แสดงให้เห็นผลลัพธ์เชิงคลินิกทั้งในมิติของความแม่นยำ เวลาในการผ่าตัด และอัตราภาวะแทรกซ้อน เมื่อเปรียบเทียบกับกระบวนการผ่าตัดที่ใช้ภาพนำร่องแบบเดิม (conventional navigation) ผลลัพธ์เชิงปริมาณที่เด่นชัดได้แก่:
- การลดข้อผิดพลาดในการระบุตำแหน่ง (localization error): ตัวชี้วัด Target Registration Error (TRE) ลดลงจากเฉลี่ย 5.8 มม. เหลือ 2.9 มม. — ลดลงประมาณ 50%.
- อัตราการลดข้อผิดพลาดเชิงคลินิก: อัตราการระบุโครงสร้างผิดพลาด (misidentification) ลดลงโดยเฉลี่ย 46% (จาก 9.6% เป็น 5.2% ของเคสทั้งหมด).
- ระยะเวลาในการผ่าตัด: เวลาผ่าตัดเฉลี่ยลดลง 16.5 นาที ต่อเคส (จาก 142.3 นาที เหลือ 125.8 นาที), โดยในกลุ่มเคสที่มีขั้นตอนการนำร่องซับซ้อนเห็นการประหยัดเวลาได้มากถึง 25–35 นาที.
- อัตราภาวะแทรกซ้อนหลังผ่าตัด: ภาวะแทรกซ้อนที่เกี่ยวข้องกับการระบุตำแหน่งโครงสร้าง (เช่น การตัดถูกตำแหน่งผิด) ลดจาก 7.5% เหลือ 4.2% — ลดลงเชิงสัมพัทธ์ประมาณ 44%.
- Latency และความต่อเนื่องของการแสดงผล: ระบบ Edge AI ที่พัฒนาให้ประมวลผลในหน่วยปลายทาง ลดค่า latency เฉลี่ยจาก ~320 มิลลิวินาที (ของระบบ cloud-based แบบเดิม) มาเป็น ~32 มิลลิวินาที ทำให้ overlay เคลื่อนที่สอดคล้องกับมือและเครื่องมือผ่าตัดแบบเรียลไทม์ (near real-time).
นอกจากตัวเลขเชิงปริมาณแล้ว ผลเชิงคุณภาพจากการสัมภาษณ์ศัลยแพทย์และทีมผ่าตัดสะท้อนถึงการเปลี่ยนแปลงของการตัดสินใจทางคลินิก ตัวอย่างเคสเด่นที่รายงานไว้ ได้แก่:
เคสที่ 1: การผ่าตัดเอาเนื้องอกตับใกล้หลอดเลือดใหญ่ — ระบบ AR ช่วยให้ทีมสามารถกำหนดแนวการตัดที่ปลอดภัยได้เร็วขึ้น โดย overlay 3D แสดงตำแหน่งเส้นเลือดย่อยที่ไม่ชัดในภาพ CT ธรรมดา ลดความเสี่ยงการบาดเจ็บเส้นเลือดและหลีกเลี่ยงการผ่าซ้ำ. ศัลยแพทย์ผู้นำทีมกล่าวว่า “ระบบทำให้เราเห็นขอบเนื้องอกและความสัมพันธ์เชิงกายภาพได้ชัดเจนขึ้น — ช่วยให้ตัดเฉพาะเนื้อเยื่อที่จำเป็นและลดเลือดออก” (คำกล่าวโดย นพ.ทิวาพงศ์ ศัลยแพทย์ตับ-ถุงน้ำดี).
เคสที่ 2: ประสาทศัลยกรรมเพื่อเอาเนื้องอกใกล้โครงสร้างสมองสำคัญ — ในเคสนี้ AR overlay ช่วยให้ลดการสลับข้อมูลและการหยุดตรวจสอบภาพข้ามจอ ทำให้การตัดสินใจแบบเรียลไทม์ชัดเจนขึ้น แพทย์ผู้ผ่าตัดระบุว่าเวลาที่ประหยัดได้ช่วยลดเวลายาชาและความเสี่ยงระบบทางเดินหายใจของผู้ป่วย
คำยืนยันจากทีมแพทย์ (คัดย่อ):
- นพ.ปริญญา (ศัลยกรรมทั่วไป): “ความแม่นยำของ segmentation 3D ทำให้ผมมีความมั่นใจมากขึ้นเมื่อต้องตัดใกล้โครงสร้างสำคัญ — การลด TRE เกือบครึ่งหนึ่งเป็นผลที่จับต้องได้ในทุกเคส.”
- นพ.สุกิจ (ประสาทศัลยกรรม): “Latency ต่ำ (<50 ms) เป็นจุดเปลี่ยน — overlay ตอบสนองทันทีกับการขยับของเครื่องมือ ช่วยให้การเปิดมุมมองและตัดสินใจรวดเร็วและต่อเนื่อง.”
- พญ.ณิชา (หัวหน้าทีมวิสัญญี): “การลดเวลาผ่าตัดเฉลี่ย 15–20 นาที ต่อเคส ช่วยลดภาระวิสัญญีและภาวะแทรกซ้อนเรื่องการดมยาซึ่งเป็นประโยชน์ต่อผู้ป่วยโดยตรง.”
ปัจจัยหลักที่ส่งผลต่อการยอมรับของผู้ใช้ระบบ AR ในห้องผ่าตัดที่สรุปได้จากการประเมินเชิงคุณภาพและการทดสอบการใช้งาน ประกอบด้วย:
- ความแม่นยำของโมเดล (Accuracy): อัตราการจับคู่โครงสร้าง 3D กับกายวิภาคจริง (low TRE และ high IoU ในการเซกเมนเทชัน) เป็นปัจจัยอันดับต้น ๆ ที่กำหนดความไว้วางใจ (trustworthiness) ของศัลยแพทย์.
- Latency และความสม่ำเสมอของการแสดงผล: Latency ต่ำและคงที่ (<50 ms) ช่วยให้ overlay เคลื่อนไหวสอดคล้องกับการกระทำจริง ลดอาการคลาดเคลื่อนเชิงรับรู้และช่วยให้ผู้ใช้ไม่หยุดการไหลของการตัดสินใจ.
- ประสบการณ์ผู้ใช้ (UX): อินเทอร์เฟซที่ไม่รบกวนสายตา การปรับความโปร่งใสของ overlay และการสลับโหมดข้อมูลอย่างรวดเร็วทำให้การยอมรับง่ายขึ้น โดยเฉพาะในสถานการณ์ฉุกเฉินหรือเคสที่ซับซ้อน.
- การบูรณาการกับกระบวนการคลินิก: ระบบที่สามารถผสานเข้ากับ workflow ปัจจุบัน (เช่น PACS, navigation tools) โดยไม่เพิ่มขั้นตอนมากเกินไป จะได้รับการยอมรับสูงกว่า.
- การฝึกอบรมและความน่าเชื่อถือของข้อมูล: ผลการทดสอบชี้ว่าการฝึกจำลองก่อนใช้งานจริงและการเปิดเผยเมตริกความไม่แน่นอนของโมเดล (confidence indicators) ช่วยเพิ่ม trust และลดความลังเลในการวางใจ overlay.
สรุปได้ว่า การนำ AR บน Edge AI พร้อมเซกเมนเทชัน 3D มาใช้จริงในห้องผ่าตัดของโรงพยาบาลไทย ส่งผลให้เกิดการปรับปรุงเชิงวัดได้ทั้งในเรื่องความแม่นยำ ลดเวลาในการผ่าตัด และลดภาวะแทรกซ้อนที่เกี่ยวกับการระบุตำแหน่ง ขณะเดียวกันการยอมรับจากผู้ใช้ขึ้นกับปัจจัยทางเทคนิค (accuracy, latency) และปัจจัยด้านการออกแบบประสบการณ์ใช้งาน (UX, workflow integration) ซึ่งต้องได้รับการพัฒนาอย่างต่อเนื่องเพื่อขยายการใช้งานในระดับโรงพยาบาลทั่วไป.
ความปลอดภัย กฎระเบียบ และจริยธรรม
ความปลอดภัย กฎระเบียบ และจริยธรรม
การนำระบบ AR ผ่าตัดแบบเรียลไทม์ที่ทำงานบน Edge AI มาใช้เชิงคลินิกต้องให้ความสำคัญกับความปลอดภัยของผู้ป่วยและข้อมูลเป็นอันดับแรก นอกจากการวัดประสิทธิภาพเชิงเทคนิค เช่น ความแม่นยำของการเซกเมนเทชัน 3D (เช่น ค่าสัมประสิทธิ์ Dice, Sensitivity, Specificity) และความหน่วง (latency) ในระบบแล้ว ยังต้องพิจารณามาตรฐานการออกแบบซอฟต์แวร์ทางการแพทย์ การจัดการความเสี่ยง และมาตรการปกป้องข้อมูลส่วนบุคคลอย่างเข้มข้น โดยเฉพาะในบริบทของห้องผ่าตัดที่ข้อผิดพลาดยอมรับไม่ได้และผลกระทบต่อผู้ป่วยรุนแรงได้ในเวลาอันสั้น
ในด้านกฎระเบียบ ระบบต้องผ่านการรับรองและการประเมินจากหน่วยงานทางการแพทย์ที่เกี่ยวข้องก่อนนำมาใช้จริง เช่น ในประเทศไทยต้องพิจารณาการขึ้นทะเบียนกับสำนักงานคณะกรรมการอาหารและยา (อย.) ในหมวดอุปกรณ์การแพทย์ประเภทที่เกี่ยวข้องกับซอฟต์แวร์ (Software as a Medical Device — SaMD) ตามเกณฑ์การจำแนกความเสี่ยงของ IMDRF และมาตรฐานสากลที่มักเป็นข้อกำหนด ได้แก่ ISO 13485 (ระบบบริหารคุณภาพอุปกรณ์การแพทย์), ISO 14971 (การบริหารความเสี่ยงทางการแพทย์), IEC 62304 (วงจรชีวิตซอฟต์แวร์ทางการแพทย์) และ IEC 62366 (การออกแบบที่คำนึงถึงการใช้งาน/Usability). สำหรับการส่งออกหรือการใช้งานในภูมิภาคอื่น ยังต้องพิจารณา FDA (สหรัฐฯ) และ CE/MDR (สหภาพยุโรป) เป็นต้น
การตรวจสอบความถูกต้องก่อนใช้งานเชิงคลินิกควรทำเป็นขั้นตอน ดำเนินการได้แก่
- การสอบเทคนิค (Technical validation) — ทดสอบโมเดลด้วยข้อมูลชนิดต่าง ๆ (phantom, คลังภาพย้อนหลัง, ข้อมูลที่มีการติดป้ายกำกับจากผู้เชี่ยวชาญ) ตรวจวัดเมตริกเช่น Dice, IoU, false-positive/false-negative rate และการวัด latency ภายใต้เงื่อนไขการใช้งานจริง
- การทดสอบทางคลินิก (Clinical validation) — เริ่มจากการทดลองเชิงสังเกต (pilot studies) ในสภาพแวดล้อมควบคุม จากนั้นขยายเป็นการศึกษาเชิงรุกแบบหลายศูนย์ (multi-center prospective studies) หรือการทดลองแบบสุ่ม (RCT) เมื่อจำเป็น เพื่อประเมินผลลัพธ์ทางคลินิก เช่น อัตราข้อผิดพลาดจากการนำทางผ่าตัด เวลาในการผ่าตัด และผลลัพธ์ต่อผู้ป่วย
- การตรวจสอบภายนอกและการรับรองอิสระ (External audit) — ใช้องค์กรประเมินภายนอกสำหรับการตรวจสอบระบบคุณภาพ กระบวนการพัฒนา และผลการทดสอบก่อนการขออนุญาต
- การทดสอบภาคสนามและการเฝ้าระวังหลังการวางตลาด (Post-market surveillance) — ติดตามประสิทธิภาพและความปลอดภัยแบบต่อเนื่อง เก็บเหตุการณ์ไม่พึงประสงค์ และมีแผนปฏิบัติเมื่อเกิดเหตุการณ์ (incident response) รวมถึงการจัดเวอร์ชันซอฟต์แวร์และกระบวนการจัดการการอัพเดตที่มีการถอนการใช้งานหรือเรียกคืนหากจำเป็น
ด้านการคุ้มครองข้อมูลและความเป็นส่วนตัว การประมวลผลบน Edge ช่วยลดการส่งข้อมูลออกนอกสถานพยาบาลแต่ก็ไม่ได้ยกเว้นความจำเป็นด้านความปลอดภัย ผู้พัฒนาระบบต้องมีมาตรการเช่น การเข้ารหัสข้อมูลทั้งขณะจัดเก็บและขณะส่ง (encryption), สิทธิ์การเข้าถึงแบบละเอียด (role-based access control), บันทึกการใช้งาน (audit logs), การทำ anonymization / pseudonymization ของข้อมูลภาพ และสอดคล้องกับกฎหมายคุ้มครองข้อมูล เช่น PDPA ของไทย หรือมาตรฐานระหว่างประเทศเช่น HIPAA เมื่อเกี่ยวข้องกับข้อมูลสหรัฐฯ
ประเด็นด้านความรับผิดชอบทางกฎหมายและจริยธรรมมีความซับซ้อน: โดยทั่วไปต้องชัดเจนว่าสถานะของระบบเป็น decision-support (ช่วยตัดสินใจ) หรือเป็นระบบที่ทำงานแบบ autonomous (ทำการตัดสินใจ/สั่งการโดยไม่มีการยืนยันจากมนุษย์) ซึ่งแต่ละสถานะมีผลต่อความรับผิดชอบทางกฎหมาย หากระบบเป็นเครื่องมือช่วยตัดสินใจ ความรับผิดชอบสุดท้ายมักตกอยู่ที่ผู้ปฏิบัติการ/แพทย์ แต่ผู้ผลิตซอฟต์แวร์ยังอาจต้องรับผิดชอบต่อข้อบกพร่องในการออกแบบหรือการให้ข้อมูลที่ทำให้เกิดความเสียหาย จึงจำเป็นต้องมีสัญญา ประกันความรับผิดชอบ และการรายงานเหตุการณ์อย่างชัดเจน
ในมุมจริยธรรม ควรคำนึงถึงปัญหาเช่น ความลำเอียงของโมเดล (bias) หากชุดข้อมูลฝึกไม่ครอบคลุมประชากรไทยหรือกลุ่มผู้ป่วยเฉพาะ จะส่งผลให้ประสิทธิภาพลดลงในกลุ่มนั้น ๆ จึงต้องมีการเก็บและทดสอบข้อมูลจากประชากรจริงในประเทศ การชี้แจงการตัดสินใจ (explainability) ก็มีความสำคัญ — แพทย์ต้องสามารถเข้าใจขอบเขตความเชื่อมั่นของการคาดการณ์ได้ เพื่อใช้เป็นข้อมูลประกอบการตัดสินใจ นอกจากนี้ต้องให้ผู้ป่วยรับทราบและยินยอม (informed consent) เมื่อระบบมีบทบาทในการดูแลรักษา
สรุปเชิงปฏิบัติการ: โรงพยาบาลและผู้พัฒนาควรวางแผนการนำระบบ AR-EdgeAI เข้าสู่คลินิกด้วยกรอบงานที่รวมการปฏิบัติตามกฎระเบียบ (เช่น การขึ้นทะเบียน อย./การรับรองสากล), การทดสอบทางเทคนิคและทางคลินิกอย่างเป็นขั้นตอน, มาตรการปกป้องข้อมูลระดับองค์กร และนโยบายความรับผิดชอบทางกฎหมายและจริยธรรมที่ชัดเจน ทั้งนี้ควรมีการเปิดเผยข้อมูลประสิทธิภาพและข้อจำกัดของระบบอย่างโปร่งใสต่อผู้ใช้และผู้ป่วยตลอดวงจรชีวิตของผลิตภัณฑ์
อุปสรรค การคุ้มทุน และเส้นทางขยายผลในอนาคต
อุปสรรคทางการเงินและโมเดลธุรกิจ (CapEx vs OpEx)
ต้นทุนฮาร์ดแวร์และซอฟต์แวร์ เป็นอุปสรรคแรกที่โรงพยาบาลต้องเผชิญสำหรับการนำ AR บน Edge AI ไปใช้ในห้องผ่าตัด โดยรวมแล้วระบบที่พร้อมใช้งานเชิงคลินิกจะต้องประกอบด้วยกล้องความแม่นยำสูง เซ็นเซอร์ 3D, เครื่องประมวลผล Edge ระดับองค์กร, ซอฟต์แวร์เซกเมนเทชันแบบเรียลไทม์ และระบบสำรองข้อมูล ซึ่งต้นทุนรวมอาจอยู่ในช่วง หลักแสนถึงหลักล้านบาท ขึ้นกับสเปคและขนาดของศูนย์ผ่าตัด
ในเชิงธุรกิจ ผู้บริหารต้องพิจารณารูปแบบการลงทุนระหว่าง CapEx (ซื้อขาด) กับ OpEx (บริการเช่า/Subscription หรือ Managed Service) โดยแต่ละรูปแบบมีข้อดีข้อเสีย เช่น CapEx อาจให้สิทธิ์ควบคุมเต็มที่และต้นทุนระยะยาวต่ำกว่า แต่ต้องรับภาระค่าเสื่อมและการอัปเกรดเอง ขณะที่ OpEx ช่วยกระจายค่าใช้จ่ายและลดภาระการบำรุงรักษา แต่ค่าใช้จ่ายต่อเนื่องอาจสูงกว่าในระยะยาว
การพิสูจน์ความคุ้มทุน (ROI) จำเป็นต้องใช้เมตริกทางการเงินที่ชัดเจน เช่น เวลาการผ่าตัดที่ลดลง, อัตราผลข้างเคียงที่ลดลง, การลดการใช้ภาพซ้ำ และอัตราการกลับมารักษาซ้ำที่ลดลง งานทดลองภายในหลายโครงการแสดงให้เห็นว่าการใช้ AR/Edge อาจลดเวลาห้องผ่าตัดและความผิดพลาดได้ซึ่งนำไปสู่ ROI ภายใน 2–5 ปี ขึ้นกับปริมาณเคสและค่าใช้จ่ายเริ่มต้น
ความต้องการด้านบุคลากรและการฝึกอบรม
การนำ AR เข้ามาใช้ไม่ได้เป็นเพียงการติดตั้งเทคโนโลยี แต่ต้องมีการเตรียมความพร้อมของบุคลากรทั้งทีมศัลยแพทย์ พยาบาลวิชาชีพ วิศวกรคลินิก และทีม IT/DevOps ทั้งนี้รวมถึงการปรับกระบวนการทำงาน (workflow) ในห้องผ่าตัดให้เข้ากับอินเทอร์เฟซแบบเรียลไทม์
- การฝึกใช้งานทางคลินิก: แพทย์และบุคลากรควรได้รับการฝึกฝนผ่านการจำลอง (simulation-based training) และฝึกในเคสจริงภายใต้การกำกับ การฝึกอาจต้องใช้เวลาเริ่มต้น 10–40 ชั่วโมงต่อผู้ใช้ ขึ้นกับความคุ้นเคยกับเทคโนโลยี
- การฝึกเชิงเทคนิค: ทีม IT ต้องมีความรู้ด้านการตั้งค่า Edge device, การจัดการโมเดล AI, การบำรุงรักษา และการตอบสนองต่อเหตุฉุกเฉินทางไซเบอร์
- การรับรองและการยอมรับทางคลินิก: ต้องสร้างหลักฐานด้านประสิทธิผลและความปลอดภัย (clinical validation) เพื่อให้บุคลากรมั่นใจและลดแรงเสียดทานต่อการเปลี่ยนแปลง
การบำรุงรักษา ความปลอดภัย และการรับประกันคุณภาพ
อุปกรณ์ Edge AI และระบบ AR ต้องมีการบำรุงรักษาทั้งฮาร์ดแวร์และซอฟต์แวร์อย่างสม่ำเสมอ รวมถึงการจัดการวงจรชีวิตของอุปกรณ์ (lifecycle management) การสำรองข้อมูล และการทดสอบความถูกต้องของโมเดล AI อย่างต่อเนื่อง
ด้านความปลอดภัย การประมวลผลข้อมูลทางการแพทย์บน Edge ลดความเสี่ยงการรั่วไหลของข้อมูลเมื่อเทียบกับการส่งขึ้นคลาวด์ แต่ยังคงต้องมีมาตรการเข้ารหัส การจัดการสิทธิ์ และการตรวจสอบการเข้าถึง (access audit) เพื่อให้สอดคล้องกับกฎระเบียบด้านข้อมูลสุขภาพ นอกจากนี้ต้องเผชิญความเสี่ยงจาก vendor lock-in และการอัปเดตซอฟต์แวร์ที่อาจส่งผลต่อความสอดคล้องกับมาตรฐานทางคลินิก
การปรับสเกลในโรงพยาบาลระดับต่าง ๆ และเส้นทางการขยายผล
การนำระบบจากโครงการนำร่องไปสู่การขยายผลในโรงพยาบาลขนาดต่าง ๆ ต้องพิจารณาประเด็นหลายด้าน: ความแตกต่างด้านงบประมาณ โครงสร้างพื้นฐาน (เครือข่ายไฟฟ้าและอินเทอร์เน็ต), ปริมาณเคสผ่าตัด และความพร้อมของบุคลากร
- กลยุทธ์แบบขั้นบันได: เริ่มจากศูนย์แพทย์ระดับสูง (tertiary centers) ที่มีเคสและทรัพยากรมากพอ เพื่อสร้างข้อมูลยืนยันประสิทธิผล จากนั้นขยายสู่โรงพยาบาลในเครือที่มีความพร้อมปานกลาง และท้ายสุดไปยังโรงพยาบาลชุมชน
- มาตรฐานและความเข้ากันได้: การออกแบบสถาปัตยกรรมแบบเปิด (open standards, interoperable APIs) จะช่วยลดต้นทุนการสเกลและป้องกันการผูกติดกับผู้ผลิตเพียงรายเดียว
- รูปแบบความร่วมมือ: การสร้างพันธมิตรเชิงพาณิชย์กับผู้ให้บริการคลาวด์, ผู้จัดหาอุปกรณ์การแพทย์ และสถาบันวิจัย จะช่วยแชร์ความเสี่ยงและต้นทุน โดยรูปแบบที่เป็นไปได้ได้แก่ Public–Private Partnerships, service leasing, หรือ pay-per-use สำหรับห้องผ่าตัดที่มีเคสน้อย
โอกาสการพัฒนาในอนาคตและการบูรณาการกับเทคโนโลยีอื่น ๆ
อนาคตของ AR บน Edge ในการแพทย์มีศักยภาพสูงในการบูรณาการกับเทคโนโลยีอื่น ๆ เพื่อนำไปสู่การดูแลที่ชาญฉลาดและปลอดภัยยิ่งขึ้น เช่น
- การรวมข้อมูลจาก real-time monitoring: การเชื่อมต่อการอ่านสัญญาณชีพ, แผนที่ภาพถ่ายอินทราโอเปอราติฟ และเซ็นเซอร์ 3D เพื่อให้ AR แสดงข้อมูลบริบทแบบทันที ซึ่งช่วยการตัดสินใจของศัลยแพทย์และลดความผิดพลาด
- หุ่นยนต์ช่วยผ่าตัด (Robotic-assisted surgery): การผสาน AR ที่ฉายเส้นทางและขอบเขตโครงสร้างสำคัญกับระบบหุ่นยนต์จะเพิ่มความแม่นยำ เช่น การใช้ AR ในการวางตำแหน่งสกรูหรือการตัดที่ละเอียดสูง
- Federated learning และการปรับปรุงโมเดลแบบกระจาย: การฝึกโมเดลร่วมกันระหว่างโรงพยาบาลโดยไม่ต้องย้ายข้อมูลคนไข้ไปศูนย์กลางช่วยเพิ่มความเป็นส่วนตัวและเร่งการพัฒนาโมเดลที่มีประสิทธิผลในสภาพแวดล้อมท้องถิ่น
- การใช้ AI ในการคาดการณ์และสนับสนุนการตัดสินใจ: การประมวลผลแบบ Edge ช่วยให้โมเดลทำนายภาวะแทรกซ้อนแบบเรียลไทม์ และ AR สามารถแสดงคำเตือนหรือแนวทางการแก้ไขทันที
สรุปได้ว่า การขยายผลระบบ AR+Edge ในการแพทย์ต้องอาศัยแผนการลงทุนที่ยืดหยุ่น การเตรียมบุคลากรและมาตรฐานทางเทคนิคที่ชัดเจน พร้อมกับพันธมิตรเชิงกลยุทธ์และการวัดผลที่เป็นระบบ หากจัดการปัจจัยเหล่านี้ได้ โอกาสในการลดความผิดพลาด เพิ่มประสิทธิภาพห้องผ่าตัด และสร้างมูลค่าทางคลินิกและเศรษฐกิจจะมีความเป็นไปได้สูงในอีก 3–7 ปีข้างหน้า
บทสรุป
การทดลองใช้งาน AR ผ่าตัดแบบเรียลไทม์บน Edge AI ในโรงพยาบาลไทยชี้ให้เห็นศักยภาพเชิงเทคนิคที่ชัดเจน—โดยเฉพาะการประมวลผลเซกเมนเทชัน 3D บนอุปกรณ์ขอบเครือข่าย (edge) ช่วยลด latency ในการแสดงผลภาพและการตอบสนอง ทำให้การวางตำแหน่งโครงสร้างกายวิภาคตรงกับความเป็นจริงมากขึ้นและลดความเสี่ยงจากความคลาดเคลื่อนระหว่างภาพนำทางกับสภาพจริงในห้องผ่าตัด ตัวอย่างจากการทดลองชี้ว่าการประมวลผลที่ใกล้ตัวผู้ป่วยช่วยย่นระยะเวลาตอบสนองและลดการรอข้อมูลจากคลาวด์ จึงลดโอกาสเกิดข้อผิดพลาดเชิงการนำทาง อย่างไรก็ตาม ผลลัพธ์เหล่านี้ยังต้องผ่านการทดสอบทางคลินิก การตรวจสอบความปลอดภัยมาตรฐานสากล การประเมินความน่าเชื่อถือด้านไซเบอร์และความเป็นส่วนตัวของข้อมูลก่อนนำไปใช้ในวงกว้าง
อนาคตของเทคโนโลยีนี้ขึ้นอยู่กับการผนึกกำลังระหว่างความสำเร็จทางเทคนิคกับโมเดลธุรกิจที่ชัดเจน การฝึกบุคลากรทางการแพทย์และวิศวกรให้ชำนาญ ระบบการรับรองทางกฎระเบียบ และกรอบการชดเชยค่าใช้จ่าย (reimbursement) ที่สนับสนุนการนำไปใช้ในโรงพยาบาลจริง การขยายผลเชิงพาณิชย์จะต้องมีการตั้งมาตรฐานการทดสอบ การฝึกจำลอง (simulation training) สำหรับศัลยแพทย์ และความร่วมมือกับผู้ผลิตฮาร์ดแวร์ Edge/AR เพื่อความยั่งยืน หากองค์ประกอบเหล่านี้ถูกพัฒนาอย่างเป็นระบบ เทคโนโลยี AR บน Edge AI มีศักยภาพช่วยยกระดับความแม่นยำของการผ่าตัด ลดเวลาทำหัตถการ และลดต้นทุนระยะยาวในการดูแลผู้ป่วย




